(每日一練)2017國家公務員考試行測備考:元素符號
更新時間:2023-08-31 09:04:21作者:佚名
學習制訂相關的學習計劃有助于我們更高效的備考,現在小編要和你們分享的是2020年高考物理備考方案專題,希望還能幫助到你們好好學習并把握這部份知識,快點學習上去吧。
2020年高考物理備考方案專題
1.【2017?北京】下列元素名稱與元素符號抒寫都正確的是()
A.鋅ZnB.硅SI
C.氯clD.貢Hg
2.國際通用的元素符號是用元素拉丁文名稱的1個或2個字母表示的,其中第一個字母小寫,第二個字母大寫。鎳元素的拉丁文名稱為Niccolum,則鎳的元素符號為()
A.NiB.NIC.ND.Na
3.【2017?山東】下列符號中,既表示一個原子,又表示一種元素,能夠表示一種物質的是()
A.HeB.N2C.HD.2O2
4.【2017?成都】我國知名物理家張青蓮博士主持測量了銻、銪、鋅等幾種元素的相對原子品質新值。如圖G1-1是元素周期表中的一部份,對圖示中元素的信息剖析錯誤的一項是()
圖G1-1
A.原子序數是“30”
B.元素符號是“Zn”
C.元素名稱是“鋅”
D.電子數是“65.41”
類別2粒子結構示意圖
5.【2017?山東】圖G1-2為鈉原子的結構示意圖。下述說法不正確的是()
圖G1-2
A.鈉原子的質子數為11
B.圖中n的值為10
C.鈉在反應中易喪失電子
D.鈉元素坐落第三周期
6.【2017?山東】圖G1-3所示的是氧原子結構示意圖和硫元素在元素周期表中的信息。下述說法正確的是()
圖G1-3
A.氧原子核外有6個電子

B.硫、氧均屬于非金屬元素
C.硫原子的相對原子品質為32.06g
D.硫、氧兩種元素產生的SO3中硫元素為+4價
7.【2016?郴州】根據原子結構示意圖和微觀示意圖改錯。
(1)如圖G1-4A、B是兩種微粒的結構示意圖,回答下述問題。
圖G1-4
①若A表示某元素的原子,則x=________。
②若B是某陽離子的結構示意圖,則y的數值或許是下述選項中的________(填字母)。
a.11b.10c.9d.8
(2)在一定條件下,A、B能發生物理反應生成C和D,其微觀示意圖如圖G1-5所示:
圖G1-5
①若D為空氣中容積分數最大的二氧化碳,則該反應中生成的C和D的質委比為________。
②若D為氧化物,且A、B的分子個數比為5∶4,則該反應的物理方程式為________________________________________________________________________。
類別3離子符號
8.請按要求用符號完成下述問題。
(1)由一種原子構成的兩種不同分子_____________________________________________________。
(2)由一種原子產生的兩種不同離子_______________________________________________________。
(3)由兩種原子構成的兩種不同分子________________________________________________________。
(4)富含兩種原子的兩種不同離子__________________________________________________________。
9.【2016?長沙】某元素是人體中的常見元素,該元素在人體內99%存在于骨格和臼齒中,其原子結構示意圖為,該元素的原子序數為________,原子核外有________個電子層;該元素屬于________(填“金屬”或“非金屬”)元素,該元素的原子喪失最內層電子所產生的離子為________(用離子符號表示)。
10.金屬鈉與氯仿在一定條件下可以發生物理反應。
圖G1-6
該反應的物理方程式:2Na+Cl2=====引爆2NaCl。依據所給信息,請回答下述問題。
(1)當鈉與硝酸反應時,每位氯原子____________成為氯離子。
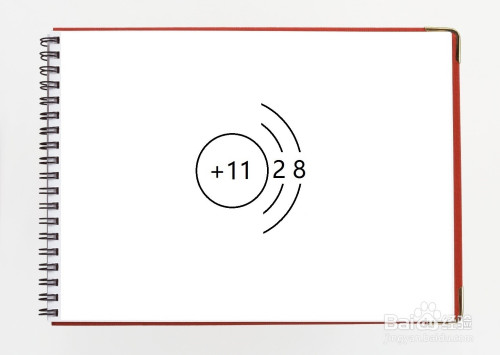
(2)從二氧化碳變為硫酸鈉時,氯元素電負性的詳細變化為____→____。
(3)硫酸鈉堿液能導電,是由于硫酸鈉溶于水產生了大量自由聯通的____________(填微粒符號)。
類別4物理式與電負性
11.【2017?長沙】下列物質的物理式寫法錯誤的是()
A.氧化鎂寫為MgOB.氧化鋅寫為ZnO
C.氧化鐵寫為FeOD.氧化鈣寫為CaO
12.笑氣是人類最早應適于醫療的全麻劑之一,笑氣是氮的一種氧化物,該氧化物中氮元素的電負性為+1,則笑氣的物理式為()
A.N2B.N2OC.N2O3D.NO2
13.許多物質的命名與元素的電負性高低有關,如錳碘化鉀、高錳碘化鉀,其中錳元素的電負性分別為+6、+7。氯元素常見的電負性有+7、+5、+1、-1等,由此推論鈉元素、氧元素和+7價氯元素三種元素組成的縮聚物的名稱為____________,物理式為__________。
類別5物理符號周圍數字的意義
14.【2017?北京】下列物理用語表示正確的是()
A.五氧化二磷的物理式:P2O5
B.硅的元素符號:SI
C.碳酸根離子:CO3
D.三個氧原子:O3
15.【2017?南京】下列物理用語表示正確的是()
A.60個碳原子:C60
B.2個氫鍵離子:2OH
C.金鋼石:Au
D.3個二氧化氮分子:3SO2
16.已知下述元素及其電負性,從其中選擇適當的元素按要求改錯。
Na0Mg+2N-3H+1O-2S+6Cl-1
(1)一種單質________________。
(2)兩種元素組成的縮聚物________________。

(3)三種元素組成的縮聚物________________。
(4)四種元素組成的縮聚物________________。
17.從C、H、O、N、S、Fe六種元素中,選擇適當的元素組成物理用語,按要求改錯。
(1)用適當的物理符號和數字改錯。
①4個銨根離子:________。
②3個二氧化氮分子:________。
(2)寫出符合下述要求的物質的物理式。
①相對分子品質最小的氧化物:________。
②菱鐵鐵礦的主要成份:________。
類別6物理方程式
18.【2017?北京】根據下述反應事實寫出相應的物理方程式。
(1)在塵埃的作用下,甲烷和二氧化碳反應生成三氧化硫(SO3):____________________________________________。
(2)Cu和AgNO3氨水反應,生成Cu(NO3)2氨水和Ag:_________________________________________________。
(3)少量CuSO4堿液滴入NaOH稀堿液中生成Cu(OH)2沉淀和Na2SO4氨水:__________________________________。
(4)一氧化碳和四氧化三鐵(Fe3O4)在低溫下反應,生成鐵和氫氣:_________________________________。
19.【2017?濟南】化學是研究物質的組成、性質以及變化規律的科學。物理學習過程要關注物質的性質以及能發生什么變化和發生變化過程中的現象。現有A、B、C三種物質,他們或許是O2、Fe、H2O、H2O2、CaO、Fe2O3、HCl、NaOH、Ca(OH)2、Na2CO3中的一種。
(1)若A、B是由相似元素組成的縮聚物,且B分解能形成A和C。請寫出該反應的物理方程式:__________________________________。
(2)若A、B中富含相似的金屬元素,并均可與C的氨水反應,生成金屬元素電負性不同的兩種鹽氨水。則C的物理式是________;請寫出能形成白色氨水的反應的物理方程式:________________________________________。
(3)若A、B、C是三種不同類型的物質,分別屬于酸、堿和鹽,將他們依次加入同一個燒瓶中:
①若均無顯著現象,則A、B、C分別是________________________(填物理式)。
②若能形成黑色沉淀,請寫出酸、堿中和反應的物理方程式:______________________________。
20.【2017?樂山】工業上生產尿素[CO(NH2)2]的反應微觀示意圖如下:
圖G1-7
(1)寫出工業上生產尿素的物理方程式:______________________________。

(2)鋰是一種活動性比鐵強的金屬,物理式為Li,鋰原子的結構示意圖為,寫出鋰與稀硝酸反應的物理方程式:________________________________________________________________________。
參考答案
1.A[解讀]硅的元素符號應為Si;氯的元素符號應為Cl;Hg的元素名稱應寫為“汞”。
2.A[解讀]由題給信息鎳元素的拉丁文名稱為Niccolum,元素符號選用第一個字母小寫,第二個字母大寫,所以其元素符號應為Ni。
3.A[解讀]He表示氦元素、一個氦原子,還可以表示氫氣這些物質;N2表示氮分子不表示氮原子;H表示氫原子、氫元素,但不表示氣體這些物質;2O2表示兩個氧分子,不表示氧原子,也不表示二氧化碳這些物質。
4.D[解讀]按照元素周期表中的一格可知,左上角的數字表示該元素的原子序數;右上角的字母表示該元素的元素符號;后邊的漢字表示元素名稱;最下邊的數字表示相對原子品質;按照原子序數=核電荷數=質子數=核外電子數,則該元素的原子核外電子數為30,該元素的相對原子品質為65.41。
5.B[解讀]由原子結構示意圖可知,鈉原子的質子數為11;核內質子數=核外電子數,圖中n的值應為8;鈉原子的最內層電子數為1,在反應中易喪失電子;在元素周期表中,元素所在的周期數與核外電子層數相等,由于鈉原子核外有3個電子層,則鈉元素坐落第三周期。
6.B[解讀]氧原子核外有兩個電子層,共有8個電子,第一層2個,第二層6個電子;硫和氧都沒有帶“钅”字旁,都屬于非金屬元素;硫的相對原子品質是32.06,相對原子品質的單位是“1”,不是“g”;氧元素在產生縮聚物常常顯-2價,按照縮聚物中正負電負性的代數和為零,可以估算出SO3中硫的電負性是+6。
7.(1)①7②a(2)①27?14
②5O2+4NH3=====一定條件6H2O+4NO
[解讀](1)①當核電荷數=質子數=核外電子數時,粒子為原子,因此若A表示某原子的結構示意圖,則x=17-2-8=7;②B是陽離子的結構示意圖鋅的相對原子質量,在陽離子中,核內質子數>核外電子數,故y是小于10的數字。
(2)①D是氣體時其反應物是二氧化碳與甲烷,產物是水與氧氣,其物理方程式是3O2+4NH3=====一定條件6H2O+2N2,則水與二氧化碳的質委比為(6×18)?(2×28)=27?14;②依據品質守恒定理,可知D一定是氮的氧化物,因A、B的分子個數比為5?4,從而寫出物理方程式是5O2+4NH3=====一定條件6H2O+4NO。
8.(1)O2、O3
(2)Fe2+、Fe3+
(3)H2O、H2O2
(4)SO32-、SO42-
(以上合理均可)
9.204金屬Ca2+
[解讀]按照在原子中,原子序數=質子數=核外電子數可得,元素的原子序數為2+8+8+2=20;20號元素是鈣元素,屬于金屬元素;從原子結構示意圖看出該元素原子核外有4個電子層;在物理反應中易喪失最內層的2個電子,產生陽離子,所產生的離子為Ca2+。
10.(1)得到1個電子(2)0-1
(3)Na+和Cl-
11.C[解讀]鎂元素、鋅元素、鈣元素在產生縮聚物時都顯+2價,氧元素在產生縮聚物時一般顯-2價,因此,氧化鎂(MgO)、氧化鋅(ZnO)、氧化鈣(CaO)的物理式抒寫均正確;氧化鐵又讀作三氧化二鐵,其中鐵元素顯+3價,氧元素顯-2價,其物理式為Fe2O3,故C項錯誤。
12.B[解讀]按照元素電負性抒寫物質的物理式:“正前負后、化簡交叉”,氧化物中氮元素的電負性為+1,氧元素的電負性為-2,縮聚物中各元素的正負電負性之和為0,故笑氣的物理式為N2O。
13.高氯碘化鉀NaClO4

[解讀]鈉元素的電負性為+1,氧元素為-2價,氯元素為+7價,高錳碘化鉀中鉀元素的電負性為+1,氧元素為-2價,錳元素+7價,與高錳重鉻酸鉀類似,故鈉元素、氧元素和+7價氯元素三種元素組成的縮聚物的名稱為高氯碘化鉀,物理式為NaClO4。
14.A[解讀]硅的元素符號為Si;碳酸根離子表示為CO32-;三個氧原子表示為3O。
15.D[解讀]60個C原子應表示為60C;2個氫鍵離子應表示為2OH-;金鋼石應表示為C,Au表示金元素、一個金原子或金這些物質;3個二氧化氮分子應表示為3SO2。
16.(1)Na
(2)MgO(或H2O或MgCl2或HCl等合理答案均可)
(3)MgSO4(合理答案均可)
(4)(NH4)2SO4(合理答案均可)
17.(1)①4NH4+②3SO2
(2)①H2O②FeCO3
18.(1)2SO2+O2=====塵埃2SO3
(2)Cu+2AgNO3===Cu(NO3)2+2Ag
(3)2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
(4)Fe3O4+4CO=====低溫3Fe+4CO2
19.(1)2H2O2=====MnO22H2O+O2↑
(2)HClFe2O3+6HCl===2FeCl3+3H2O
(3)①HCl、NaOH、Na2CO3
②2HCl+Ca(OH)2===CaCl2+2H2O
[解讀](1)A、B是由相似元素組成的縮聚物,且B分解能形成A和C,可知B是酰基化氫,A是水,C是二氧化碳,酰基化氫在重鉻酸鉀催化下分解成水和二氧化碳。(2)已知的物質中,金屬元素具備可變電負性的只有鐵,鐵與稀硫酸反應生成硫酸亞鐵,
氧化鐵與稀硫酸反應生成氯化鐵,因此C是硫酸(HCl);稀硫酸和氧化鐵反應生成白色的氯化鐵氨水和水。(3)①A、B、C分別為酸、堿、鹽,依次加入到同一個燒瓶中無現象,則A是硫酸(HCl),B是氫氧化鈉(NaOH),C是碳碘化鉀(Na2CO3);由于氫氧化鈉加入硫酸中反應生成甲酸鈉和水,無現象,碳碘化鉀加入到硫酸鈉氨水中不發生反應,無現象;②如果能形成紅色沉淀,則A是硫酸,B是氫氧化鈣,C是碳碘化鉀;硫酸和氫氧化鈣反應生成乙酸鈣和水鋅的相對原子質量,硫酸鈣和碳碘化鉀反應生成氯化鈣沉淀和硫酸鈉,其中硫酸和氫氧化鈣發生的是中和反應。
20.(1)2NH3+CO2=====一定條件CO(NH2)2+H2O(2)2Li+H2SO4===Li2SO4+H2↑
相關文章:
1.2020高考物理學習技巧
2.最新2020高考物理備考資料
3.2020高考語文復習備考計劃方案
4.2020高考各個課目復習策略
5.2020高考語文復習總體備考方案